The Endoplasmic Reticulum
핵 외의 membrane-enclosed organelles; ER, Golgi, lysosome, endosome, plasma membrane, …
; membrane-enclosed organelle로 가거나 plasma membrane 바깥으로 secretion되는 단백질들은 처음부터 구분된 경로로 합성되고 운반된다, 대부분 ER membrane 상에서 합성이 시작된다
; protein secretion, secretory pathway (모든 단백질들이 이 경로로 가는 것은 아님)
ER
; 핵의 outer membrane은 ER membrane과 연속적
; ribosome 유무에 따라 rER과 sER로 나눌 수 있음, rER은 단백질 합성/sER은 lipid metabolism
; ER에서 생성된 vesicle들이 Golgi로 이동하는데, ER의 맨 끝부분/Golgi의 시작 부분에 있는 ER 구조를 transitional ER, ERGIC라 함
Protein secretion 실험
; 소화효소를 대량으로 만들어 세포 바깥으로 분비시켜주는 것에 특화된 세포 type, pancreatic cell, rER, Golgi, Secretory vesicle 발달
; 세포 배양하며 radiolabeled amino acid 넣어줌 (S35)
; 3분 동안 집어넣어준 다음 다시 정상 아미노산으로 교체 > 방사선이 rER network에서 많이 관찰
; 7분 > golgi에서 많이 관찰, 2시간 > secretory vesicle에 있거나 이미 세포 바깥으로 배출
; 소화효소를 구성하는 단백질들은 rER에서 만들어져서 Golgi > Secretory vesicle > cell exterior 경로로 감 (secretory pathway)
protein trafficking의 중요한 branch point는 ER ribosome / cytosol ribosome 중 어디서 합성이 시작되는지 > 종착지가 크게 달라짐
; free ribosome에서 합성된 단백질은 상당한 분량은 cytosol에 존재하는 단백질이 됨(cytosolic protein)
; 이동하는 애들은 핵/미토콘드리아/엽록체/퍼옥시좀 내부로
; post-transcriptional translocation을 통해 뒤늦게 secretory pathway로 가는 애들도 있음
; rER membrane-bound ribosome에서 합성된 단백질은 상당 분량 ER membrane/ER lumen로, ER에 계속 남아 있음
; 일부는 golgi로 이동, 또 그중 일부는 secretory vesicle로 이동하여 세포 바깥으로 secretion
; 일부는 ER membrane, golgi membrane을 거쳐 plasma membrane/endosome으로 이동하기도 함
; 일부는 peroxisome membrane으로
; 일부는 ER membrane으로 들어온 후 nuclear membrane으로 이동 (ER membrane과 nuclear membrane과 연속적이므로)
ER membrane으로 targeting된 단백질들은 cotranslational translocation pathway을 거침; ER membrane에서 translation이 진행되면서 동시에 ER lumen/ER membrane으로 translocation
모두 그렇지는 않음. cytosol에서 다 만들어진 단백질들이 다시 ER pathway로 들어오는 posttranslational translocation도 일어남
Cotranslational translocation
; ribosome이 어떻게 ER membrane으로 targeting 되며 ER membrane을 가로질러 진행될 수 있는지
; 단백질이 secretory pathway로 들어가려면 signal sequence라는 특정 아미노산 서열을 가지고 있어야 함
; signal seqeunce는 보통 N terminal에 존재, 평균 20aa 정도 크기, hydrophobic aa
; signal sequence를 가지고 있는 단백질이 만들어지면 단백질뿐 아니라 단백질이 만들어지는 ribosome 전체가 ER membrane으로 recruit됨
*microsome
; 세포를 깼을 때 세포를 이루던 membrane 성분들이 자기들끼리 모여서 microsome을 형성, 대부분 ER membrane 기원(제일 넓음)
; density gradient centrifugation을 통해 rough microsome / smooth microsome 분리해서 확보할 수 있음
; microsome을 이용해 단백질 합성 실험 가능, 그때 만들어진 단백질은 microsome 내부로 들어감
signal seqeunce
; ER signal sequence만 있으면 단백질을 secretory pathway로 보낼 수 있음, 단백질의 다른 부분은 information 주는 데 기여 x (swapping experiment)
; signal sequence 자체는 광범위한 용어, 어떤 단백질을 어디로 보낼지! (일반적인 address lable 역할) > 여러 종류의 signal sequence 포함, ER signal sequence을 주로 signal sequence라 말하긴 함
; ER에 계속 있도록 해 주는 retention sequence도 있음(KDEL)
; mitochondria로 보내는 presequence
; nucleus로 보내는 NLS
; chloroplast로 보내는 transit peptide
signal sequence가 어떻게 작동하여 ER pathway로 단백질을 보내는가
; SRP, signal recognition particle – signal sequence 인식하는 RNP complex
; signal sequence의 인식은 SRP protein이, protein conformation 형성을 위해서는 complex 형태로 있어야 함
; cytosol의 free ribosome에서 만들어지기 시작하는 단백질 > N terminal의 signal sequence를 SRP가 인식해서 binding > SRP가 ER membrane의 SRP receptor를 찾아감 > SRP receptor 옆의 translocon channel에서 polypeptide 계속 합성 > signal peptidase는 signal sequence를 인식해서 끝부분을 자름, 잘리지 않는 경우도 있음 > polypeptide가 lumen으로 release
*translocon
; yeast/mammalian의 translocon은 polypeptide chain 3개가 만나서 생긴 가운데 구멍이 뚫린 구조, 단백질 세 개가 하나의 membrane spanning pore 형성
; bacteria는 secretory pathway 가지는 대신, cytosol에서 단백질을 만든 후 세포 바깥쪽으로 내보낼 단백질들은 bacterial plasma membrane의 translocon을 통해 배출
; protein을 membrane system 안팎으로 이동시킬 때 유사한 translocon들이 작동
Posttranslational translocation
; 다 만들어진 polypeptide가 chaperone binding 상태로 cytosol에 머물다가 signal sequence가 뒤늦게 Sec62/63 complex에 의해 인식 > translocon으로 들어오면 ER lumen에서 작동하는 Hsp70 chaperone인 BiP가 ATP를 가수분해하며 polypeptide chain을 ER lumen쪽으로 당김(hydrophobic sequence를 인식하면서)
Insertion of proteins into the ER membrane
; lumen에 머무르지 않고 membrane 구성성분(ex. ER/Golgi/endosome/plasma membrane의 구성성분)으로 들어가는 애들도 있음
; ER에서 membrane protein으로 결정됨, integral membrane proteins
; integral membrane protein이 되려면 fatty acid로 구성된 hydrophobic environment에 잘 들어가기 위해 단백질이 α-helix 구조를 형성, hydrophobic side chain을 바깥쪽으로 노출 > fatty acid와 hydrophobic interaction > polypeptide chain이 membrane을 span
; 중간에 두 번째 signal sequence로 internal transmembrane sequence(signal sequence의 일종, hydrophobic)가 있는 경우 > membrane anchoring > translocon의 불안정화, 분해 > membrane의 lipid bilayer으로 나옴 > membrane spanning domain이 됨
; translocon lumen/ER lumen은 hydrophilic, translocon의 membrane spanning domain은 hydrophobic > hydrophobic한 amino acid patch를 만나면 transmembrane sequence는 translocon lumen으로 들어가지 못함
; 이러한 원리로 다양하게 inegral membrane porteins 형성
ex. N terminal/C terminal의 위치 바뀐 경우
ex. internal signal seqeunce가 여러 번 나타나는 경우 > transmembrane domain이 여러 번 형성되며 membrane을 여러 번 spanning하는 integral membrane protein 형성(이때 처음 등장하는 internal signal sequence를 start transfer sequence, 마지막에 등장하는 internal signal sequence를 stop transfer sequence)
; signal sequence가 C terminal에 존재하는 경우 > 구분되는 SRP가 인식(TRC40) > 구분되는 SRP receptor가 인식(GET1-GET2 complex) > ER membrane incorporation
; ER lumen 쪽은 cell exterior 쪽과 topologically equivalent > membrane protein을 incorporation시킬 때 topologically 정확하게 시켜야 함
Protein folding and procesisng in the ER
; ER lumen에서 작동하는 chaperone으로 가장 유명한 건 BiP > protein이 정확한 3차원적 구조를 형성하도록 도와줌
; PDI중 일부도 ER 안에 있어서 cytosol에서처럼 disulfide bridge를 만들어 정확한 3차원적 구조를 가지도록 도와줌
; 일부는 protein glycosylation / GPI anchoring를 통해 ER membrane에 loose하게 연결된 단백질로 존재하기도 함(둘 다 ER에서 진행됨)
- protein glycosylation
; membrane lipid의 Dolichol phosphate에 14개의 당이 연결되어 N-linked oligosaccharide로 기능 > protein importing 시 protein의 Asn을 만나면 당이 옮겨감 > N-linked oligosaccharide를 가진 glycoprotein의 합성(at ER) > 끝의 3개의 glucose 제거(at ER) > golgi로 이동 > further modification
; 일부 ER로 삽입되는 단백질들은 glycoprotein으로 변화할 수 있다, protein glycosylation의 일부는 ER에서 일어난다 - GPI anchoring
; ER 안으로 삽입된 단백들 중 일부는 GPI anchoring
; phosphate group과 glycosyl group을 가지고 있는 inositol이 ER membrane에 존재하는 단백질을 attack > 단백질 전체를 lipid와 연결된 당에 붙임
; ER integral membrane protein이 GPI anchoring을 통해 ER membrane 주변에서 돌아다니는 ER pheripheral membrane protein이 됨
Quality control in the ER
; misfolding된 단백질들은 ERAD(ER-associated degradation) pathway로 옮겨지면서 파괴됨
ERAD 중 하나로, misfolding이 크게 일어났을 때 UPR이 일어남
; ER lumen에 감당할 수 없을 만큼 많은 misfolding protein이 존재할 때
; membrane에 존재하는 다양한 sensor들(IRE1, ATF6, PERK) > 구조를 인식해 misfolded protein 감지
; IRE1는 splicing이 마무리되지 않은 XBP1 pre-mRNA의 cleavage를 통해 XBP1 transcription factor를 만듦
; ATF6는 golgi로 이동해서 golgi에 존재하는 protease에 의해 윗부분이 잘려서 release(그 자체가 transcription factor; membrane-anchored transcription factor)
; PERK는 eIf2를 phosphorylation시켜서 저해 > ribosome에 의한 단백질 합성이 전반적으로 줄어듦(general inhibition of translation) > 특정 mRNA의 translation은 오히려 촉진, ATF4 translation 촉진, ATF4는 transcription factor로 작용
; transcription factor들은 chaperone encoding 유전자 발현 늘리고, lipid를 합성 촉진해서 ER membrane 면적 늘리고, ERAD에 필요한 protein 늘림(misfolding된 애들을 더 빨리 제거), mRNA 분해 촉진
; 이렇게 해도 안 되면 programmed cell death로 감
glycoprotein의 folding을 도와주는 chaperone들 – 대표적으로 calnexin과 calreticulin
; glycoprotein의 glucose 2개가 잘리고 glucose가 하나 남은 glycoprotein이 calnexin/calreticulin에 의해 folding
; correctly folding되면 나머지 한 glucose도 제거되고 완성된 glycoprotein이 golgi로 이동
; folding 실패하면 misfolded protein은 같은 과정을 계속해서 반복 (glucose를 또 붙이고 calnexin/calreticulin이 또 folding 시도)
; 그래도 안 되면 당을 모두 제거하고 ER 바깥으로 다시 보내는 retro-translocation > translocon 한쪽에 위치한 ubiquitin ligase complex에 의해 protein이 poly ubiquitination > cytosol에서 proteasome을 만나 degradation
The smooth ER and lipid synthesis
sER의 가장 중요한 기능인 membrane lipid 합성
; membrane lipid의 합성은 soluble part(aqueous environment)에서 이루어지지 않음, 이미 세포 내 존재하는 membrane system 상에서 이루어짐, 지질 성분을 handling해야 하기 때문
; phospholipid, glycolipid, cholesterol(특히 동물세포에 많음)이 주요한 lipid type
phospholipid의 합성
; soluble하여 수용성 환경에 녹아있는 glycerol를 sER membrane으로 위치시킨 후 CoA가 fatty acid를 hydrophobic pocket에 담아서 데려옴
; glycerol 3-phosphate backbone 위에 fatty acid를 붙여줌 > 결합하면 phosphatidic acid 생성
; phosphatidic acid에서 phosphate를 떼면 diacylglycerol이 만들어지는데, 이를 추가적으로 변형시킴으로써 여러 종류의 phospholipid가 탄생
; choline을 붙이면 phosphatidylcholine, ethanolamine을 붙이면 phosphatidylehtanolamine, …
; membrane 상에 존재하는 여러 종류의 phospholipid를 sER membrane에서 만듦 by membrane-bound enzymes, cytosolic face에서
sER membrane에는 유독 cytosolic face에서 새로 만들어지는 phospholipid가 많음 > phospholipid bilayer의 불균형
; membrane에 존재하는 flippase가 균형을 맞춰줌 by transport
; phospholipid의 합성은 cytosolic half에서 이뤄지지만 flippase가 연속적으로 작용하기 때문에 궁극적으로는 lipid bilayer 전체가 성장한다
cholesterol, ceramide는 전혀 다른 방식으로 만들어짐
; 거의 대부분 sER에서 만들어짐
; ceramide는 final product가아님 > sER에서 만들어지지만 transport vesicle을 통해 golgi로 이동해서 glycolipid, sphingomyelin으로 변형
=> sER은 phospholipid, cholesterol, glycolipid의 전구체인 ceramide의 합성에 있어 주요한 역할을 함
Export of proteins and lipids from the ER
; rER에서 만들어진 protein, sER에서 만들어진 membrane lipid는 transport vesicle을 통해 여러 다른 세포소기관으로 이동해야 함
; ER > Trans ER > ERGIC > Golgi 로의 정방향 이동
; 때에 따라서는 역방향으로 다시 이동하는 경우도 있음, retrieval pathway
ER에 잔류할 애들 / 다른 데로 이동해야 할 애들을 나누기
; transport의 방향성을 결정짓는 specific signal이 작동, proteins targeted for export는 peptide signal(protein 자체)이나 peptide에 추가로 붙은 carbohydrate signal를 가짐
; signal 없이도 이동하는 애들도 있음, default pathway (signal을 가진 애들과 함께 붙어서 이동하는 것도 포함)
; ER 내부에서 계속 작동해야 하는 애들은 이동하지 않거나, 이동하더라도 ER로 다시 돌아와야 함 – ER retention signal KDEL, KKXX(back transport), ex. BiP, signal peptidase, PDI
The Golgi Apparatus
Golgi의 역할
- further processing
; ER에서 받은 물질을 추가적으로 수정해서 fianlize(final form)
; ceramide 형태의 membrane lipid에 다양한 당을 붙여서 glycolipid로(cytosolic side에서), phohsphorylcholine group을 붙여서 sphingomyelin으로 만들어줌(golgi lumen surface에서)
; protein processing, protein modification이나 protein에 당을 붙여 glycoprotein 형태로 완성, 제일 많이 연구된 것이 processing of N-linked oligosaccharides(ER에서의 변형 이후의 일)
; golgi에는 추가로 당 붙여주는 효소 glycosyltransferase, 붙은 당을 제거하는 효소 glycosidase 둘 다 다양하게 존재
; lysosome으로 가야 하는 N-linked oligosaccharide에는 mannose-6-phophate가 일어남 > 그 3차원적 구조가 membrane에 존재하는 mannose-6-phosphate receptor에 의해 인식 > lysosome으로 가는 targeting signal로 작용(signal sequence가 아닌 signal patch, 당이 가지는 3차원 구조)
; O-linked glycosylation도 진행됨, 매우 다양한 형태의 glycoprotein들이 golgi에서 탄생, 당이 붙는 패턴이 단백질의 기능을 결정해 주기도 함, 당이 붙은 후 추가적인 modification도 일어남 - sorting
; golgi를 거쳐 final destination으로 보내줌, secretory pathway에 존재하는 다른 세포 소기관 중 어디로 보낼 것인지 최종 결정, golgi에서 생성되는 transport vesicle은 다양
; trans-Golgi network에서 유래된 transport vesicle의 일부는 late endosome으로 fusion, late endosome이 maturation되면 lysosome
; 또 다른 transport vesicle은 recylcing endosome으로 이동, recylcing endosome은 받아서 또 transport veiscle을 만들어 세포 바깥쪽으로 내보냄
; 조절과정이 없는 constitutive secretion, transport vesicle이 생성되면 무조건 plasma membrane으로 나감
; vesicle이 만들어져서 기다리고 있다가 세포에서 신호를 받으면 그제야 secretion되는 regulated secretion ex. hormone 배출할 때, 시냅스로 neurotransmitter 배출할 때
- 식물세포의 golgi는 cell wall을 이루는 polysaccharides 대량 생성
- golgi를 영역에 따라 구분하면 cis, medial, trans
golgi stack들간의 물질 수송에 관한 두 가지 model (controversial)
- stable cisternae model; cisternae는 안정적으로 유지되는 구조이고, transport vesicle을 통해 한 cisternae에서 다음 cisternae로 물질 수송
- cisternal maturation model; cisternae 자체가 maturation되면서 다음 cisternae로 변한다, transport vesicle은 별 역할 x
사면이 동일한 모양을 가지고 있지 않고, 면에 따라 다른 모양을 형성하며 이에 따라 다른 기능을 수행하는 세포 – 소장벽을 이루는 소장 상피세포
; 세포 표면을 넓히는 microvilli가 발달해 있으며 소장 lumen과 접해 있는 apical membrane, 세포들이 서로 인접한 lateral surface, 기질과 접해 있는 basal surface (합쳐서 basolateral membrane)
; membrane이 fusion되며 만들어지는 tight junction을 경계로 독립된 세계 형성 (apical / basolateral) > 서로 다른 모양, 구성성분, 기능 수행 > polarized cell
; polarized cell은 각 면이 각 기능을 수행하기 위해 setup된 상태를 유지해야 함
; golgi를 통한 secretory pathway 또한 polarized되어 다른 종류의 constitutive vesicle을 만들어서 보내야 함 > 정밀한 sorting
식물세포나 yeast cell에는 lysosome이 없고 이와 비슷한 기능을 vacuole이 수행
; 그외에도 식물세포에서는 다양한 일을 수행 including macromolecule degradation
; lysosome에서와 달리 signal patch 대신 signal sequence가 vacuole로 오도록 기능
The Mechanism of Vesicular Transport
experimental approaches
• secretory pathway에 mutation이 생긴 yeast mutants 사용
• cell-free system에 원하는 방식으로 vesicle을 reconstitution
• 신경세포를 배양하여 synaptic vesicle을 생화학적으로 분석
• 원하는 단백질에 GFP를 붙여서 실시간으로 tracking
• 특정한 type의 secretory compartment를 꺼내서 그 안에 어떤 component가 존재하는지 분석
membrane의 budding off (어떻게 잘려 나와서 transport vesicle을 형성하는가)
; coated vesicle 개념 등장, vesicle이 budding off 될 때 바깥 쪽에 coating되면서 그것이 driving force를 제공한다
; vesicle의 coating 자체가 조절적인 process, 조절에서 핵심적인 역할을 하는 것이 small GTP-binding proteins, GTP 가수분해 에너지를 활용하면서
; 이동할 때에는 cytoskeleton으로 만들어진 highway를 따라 이동, target membrane을 만나면 coat가 벗겨지며 fusion됨
coated vesicles
; coat의 구성성분은 COP class의 단백질과 clathrin 계통의 단백질, 이에 따라 vesicle이 활동하는 영역이 다르다
; COP2 coated veiscle들은 ER to ERGIC/Golgi에서, COP1 coated vesicle들은 Golgi to ER(retrieval pathway)에서, clathrin coated vesicle들은 Golgi와 plasma membrane 사이의 남은 모든 영역에서 활동
Vesicle Fision, vesicular transport의 cargo selection
; small GTP binding protein이 중요하게 역할
ex. small GTP binding protein인 Arf는 clathrin coat를 입히는 데 중요하게 역할
; GEF에 의해 생성된 GTP binding Arf는 adapter protein와 interaction > adapter protein은 recpetor와 interaction > receptor에는 cargo가 부착됨 > adapter 상에서 clathrin 단백질이 assembly 시작 > 계속해서 ATP를 사용하며 clathrin coat가 형성 > 자연적으로 membrane을 바깥쪽으로 돌출시킴, budding 진행 > dynamin이 vesicle neck 부분을 자르며 vesicle fision> transport vesicle 내부에 receptor specific한 cargo 실림
; small GTP-binding protein 중 무엇이 선택되냐에 따라 receptor 결정, cargo 결정(cargo selection) > transport vesicle의 종류에 따라 서로 다른 종류의 small GTP-binding protein이 사용됨
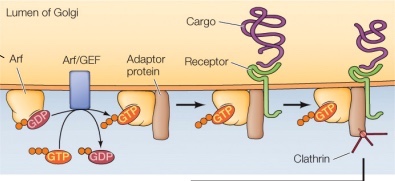
vesicle fision > transport > vesicle fusion
; fision과 fusion에는 모두 small GTP-binding protein이 specificity를 결정하는 데 중요하게 작용
Vesicle Fusion
; tethering factor와 small-GTP binding protein 중 Rab family가 중요(target membrane과 vesicle membrane간의 specificity를 결정하는 데에 중요한 역할 수행)
; vesicle membrane이 target membrane과 fusion되는 데 필요한 에너지를 제공해주는 SNARE proteins(transmembrane proteins)
; transport vesicle의 v-SNARE과 target membrane의 t-SNARE가 coiled-coil interaction > 밀착시키며 fusion
Lysosomes
lysosomes
; 동물세포만 lysosome을 가지고 있다고 간단히 정리 가능
; 세포 수준에서 물질을 파괴해서 소화하는 specialized 기관
; 60여 종류의 효소를 가지고 있음, 대부분 polymer에 물 분자를 첨가하여 polymer를 monomer로 분해시키는 acid hydrolases, 산성 조건에서만 활성을 보임(lysosome이 간혹 터지더라도 효소들이 세포의 다른 물질들이 분해시키지 않기 위해, lysosome에서만 기능하도록), lysosome 내부의 acidic pH를 유지하기 위해 proton pump가 proton을 lyososome 쪽으로 pumping해주는 역할
; 내부에는 거의 대부분의 macromolecule을 분해시킬 수 있는 소화효소가 있음 ex. nucleases, proteases, glycosidases, lipases, …
; lysosomal membrane 자체는 효소에 의해 분해되지 않는데, highly glycosylated membrane protein을 그 원인으로 추정함
; lysosome 관련 질병, 효소 중 일부가 유전적 결함으로 발현이 안 되거나 존재하지 않을 때 특정 종류의 macromolecule이 분해되지 않고 lysosome 내부에 쌓이면 lysosomal storage diseases가 발생 (소화 효소의 결함으로)
endocytosis
; 세포막이 함입되면서 endocytic vesicle 만듦 > early endosome에 fusion > early endosome의 구성 물질 중 재활용이 필요한 물질(plasma membrane 성분, receptors)은 recycling vesicle이 형성돼 recycling endosome으로 보내짐 > recycling endosome은 또 다시 vesicle을 형성해 plasma membrane 쪽으로 보내줌 > 다시 plasma membrane으로
; early endosome은 더 많은 물질들을 공급받으며 late endosome, lysosome으로 차례로 maturation
; early endosome은 일종의 간단한 sorting function을 가짐(recycling pathway와 lysosome pathway로 보낼 것들 분류)
; secretory pathway를 통해 golgi로부터 lysosome으로 기능하는 데 필요한 소화효소들을 받고, endocytic pathway를 통해 세포 바깥의 물질들을 받으며 lysosome이 됨
; early endosome은 secretory pathway(세포 안>바깥)와 endocytic pathway(바깥>안)가 만나는 지점
autophagy
; endocytosis는 pinocytosis(liquid&liquid-soluble molecules만 함입될 때)와 phagocytosis(커다란 덩어리가 들어올 때 ex. bacteria, aged cells)로 구분 가능
; own cellular component를 소화하면 autophagy ex. aged/damaged mitochondria 제거 시
; phagocytosis를 통해 bacteria나 rbc를 데리고 들어오는 endocytic vesicle을 phagosome이라 부름, lysosome과 합쳐지면 phagolysosome
; 비슷한 process로 autophagy가 일어남, ER membrane의 일부가 대상을 둘러싸고 autophagosome을 형성, lysosome과 합쳐지면 phagolysosome